医疗器材财富链先容13个财富链分类目次医疗器材财富园简
本文将对医疗器材工业界限、工业布局、区域散布、企业大概、产物大概、投融资大概、系列榜单等举行梳理,以供参考。
中国医疗器材工业发扬势头杰出,本领继续迭代升级,工业生态逐步圆满,工业界限增速进步环球。2023年中国医疗器材工业界限到达11841.7亿元,增进率为16.3%比环球增进率高7.7个百分点。正在计谋启发、需求牵引、本当先进的驱动下,中国医疗器材工业将迎来更大发扬空间,估计2025年工业界限希望进步1.6万亿元。
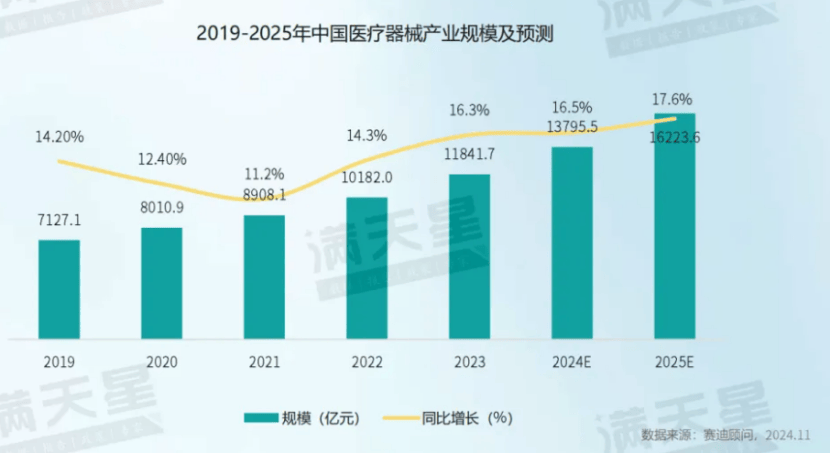
医疗装备是中国医疗器材工业界限占比最大的细分周围。2023年,中国医疗装备工业界限到达6547.1亿元,占完全医疗器材工业的55.3%。其次是高值耗材、体表诊断低值耗材,划分占完全医疗器材工业的比重为18.0%、15.2%、11.5%。
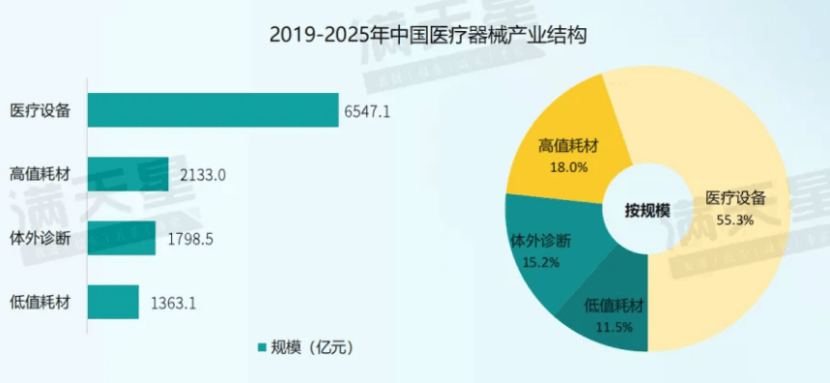
2023年,华东、中南地域医疗器材工业界限合计占天下的比重到达76.7%,是中国医疗器材工业高度聚积的地域。个中,华东地域医疗器材工业界限到达5366.5亿元,占天下的比重为45.3%;中南地域医疗器材工业界限到达3714.1亿元,占天下的比重为31.4%。从首要都市来看,北京医疗器材工业以“精而强”为发扬特质,酿成了革新研发才气一流、工业链区域配套完好的高端医疗器材工业集聚发扬高地;上海张江、临港医疗器材园区吸引了稠密革新型总部落地,同时也是表商投资的核心区域;长沙、武汉、广州等中南部都市有坚固的修设业底子,收集了稠密坐褥型企业,慢慢构修起研发、坐褥发卖流利的全工业链条。
截至2024年9月,中国医疗器材坐褥修设企业数目为5.8万家,个中高新本领企业4000余家,上市企业263家。将来,中国高端医疗器材产物和干系企业新增注册量仍将接连增进。

趋向一:行业聚积度接连晋升,并购重组和战术互帮成为主流。正在集采后台下的重塑期,具有界限效应和雄厚产物线的企业处于有利名望,以工业链上下游整合和同业业之间补短板型的并购形式成为主流。为普及界限效应,企业纷纷挑选以并购重组、战术互帮等形式,整合行业资源,普及市集竞赛力。
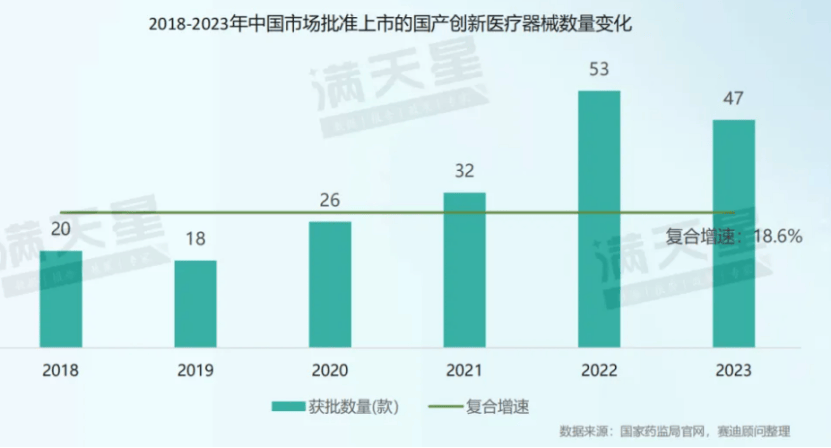
趋向二:企业加快组织高端市集,本领革新是中央竞赛力。2019-2023年,每年获取国度药监局革新医疗器材审批的企业数目接连增添,由2019年的18家增进至2023年的47家,企业纷纷加大研发革新,启迪高端赛道。重离子放射医疗体例质子放射医疗体例、体表膜肺氧合医疗装备等国产高端产物完毕零的打破并进入临床利用。
趋向三:中国脉土厂商崭露头角,出海成为新引擎。近年来,中国脉土厂商势力巩固,部门企业正在环球市集“站稳脚跟”。2014-2023年,中国高端医疗器材出口额完毕十年翻一番,2023年出口额到达174亿美元。本土企业的多项产物正在海表获取注册证,东南亚、中东、北非、北美等地域成为出海重心。
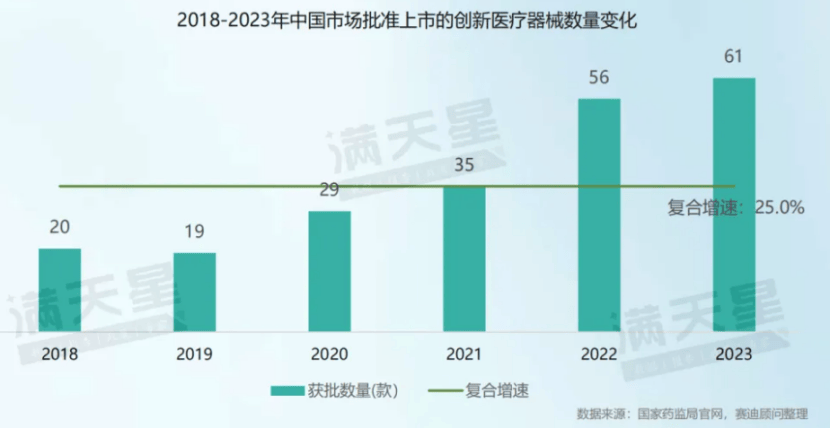
革新医疗器材加快放量。中国医疗器材工业革新进入迅疾发扬黄金光阴,革新医疗器材产物获批数目由2018年的20款增进至2023年的61款,复合增进率为25.0%。国产革新医疗器材占比接连普及。正在国度计谋救援、企业研发加入继续增进的后台下,中国医疗器材企业革新加快。正在2018-2023年获批的革新医疗器材中,国产革新医疗器材占比接连进步70%。
遵循多成数科的数据,截至2024年8月12日,本年医疗器材共涌现294起投融资项目,相较2023年同比增进13.08%。
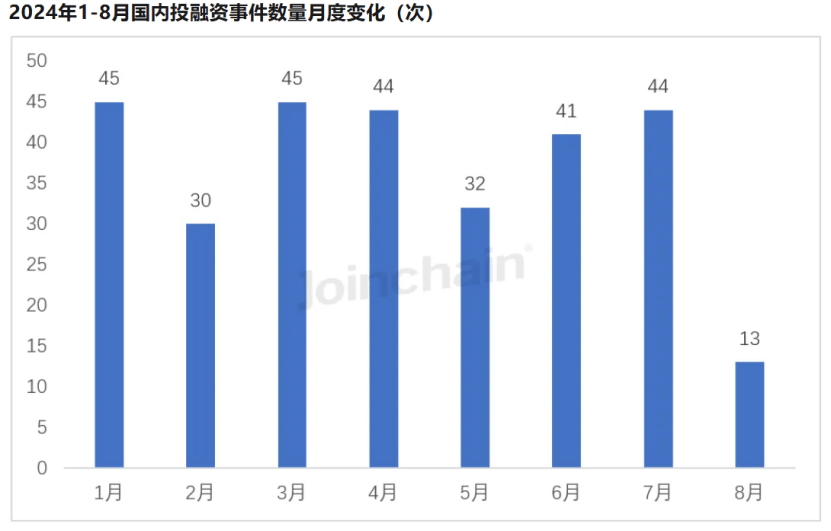
从已披露投融资风从来看,本年目前三大热点投融资周围划分是体表诊断周围(含试剂及仪器)、医学影像周围及手术医疗装备周围。体表诊断周围相较于客岁多了9起融资事情,医学影像周围多了4起融资事情,手术医疗装备周围多了20起融资事情。
对付始创企业而言,产物从研发打算阶段到走向消费市集,起码应体验打算开荒、注册检测、临床试验、注册申报、坐褥许可申请等漫长的无红利经过。那么,何如评估产物平和性危害、申报注册周期、加入资金与本钱?都是始创企业创始人最亲切的题目。
基于上述题目,笔者拾掇此文,心愿对正踏步进军医疗行业的始创企业有所帮帮。本文将遵循工商注册、产物打算开荒、编造树立、革新产物申报(若涉及)、注册检测、临床试验、注册申报、坐褥许可申请、产物上市等须要阶段举行大略先容。
现现在,公司实行注册资金认缴造和三证合一挂号轨造,注册流程大为简化,注册用度大为节俭,注册周期也大为缩减。但正在公司注册前,需负责推敲筹划限造,前置研究将来产物坐褥限造,避免后续再做更改。
产物打算开荒可分7个阶段:筹划阶段、打算输入阶段、打算输出阶段、幼试阶段、中试阶段、定型阶段、注册材料计算阶段。详情见图1。
寻常而言,创始人创立公司是基于科研劳绩与产物组织底子上,并已发轫具备研发团队、互帮伙伴等。但无论何如,对付始创公司而言,因涉及大宗资金注入与本领攻坚,产物打算开荒阶段特别辛苦,时分也是难以预估的,短则数月,长则数年。那么,何如正在产物打算开荒阶段低浸本钱,满意需求,增添革新?
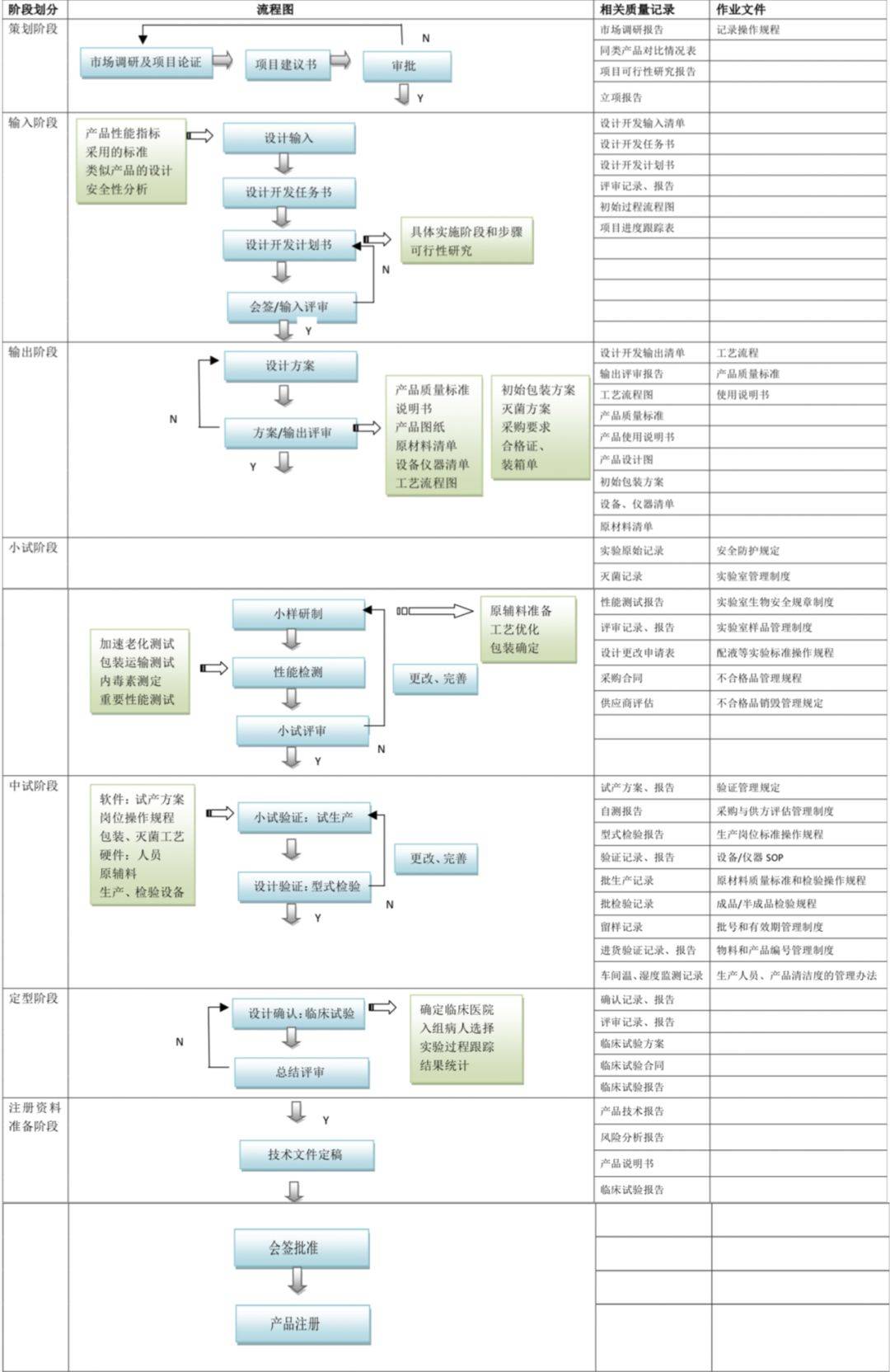
最初,产物本领层面,专业高效的研发团队是条件和底子;其次,法例层面,发起寻找专业CRO公司或引进法例团队对产物开荒举行厉苛的危害评估,昭彰产物申报类型等。但咱们通常挖掘,良多新办企业正在产物已定型、开模后,才出手引进法例职员或寻找商议机构。此时的发起和方法往往基于抢救,告急的可以涉及改模、从新打算等。因而对付新办企业而言,法例前置矜重考量。结果,还应体贴产物专利组织。公司应核心组织中央本领的学问产权维护,同时还应试虑中央本领让渡、进货等题目,而产物的专利申报能够委托相应机构,后期若涉及专利较多,亦可引入兼职或专职职员。
2014年2月7日,CFDA宣告了《革新医疗器材格表审批步骤(试行)》(食药监械管〔2014〕13号),此文献自2014年3月1日起实践。该步骤是正在确保上市产物平和、有用的条件下,针对革新医疗器材树立的审批通道,但也有厉苛的审批准绳:(1)产物中央本领发现专利权。审批申请人经由其本领革新举止,正在中国依法具有产物中央本领发现专利权,或者依法通过受让获得正在中国发现专利权或其行使权;或者中央本领发现专利的申请已由国务院专利行政部分公然。(2)国内初创产物。首要就业道理/感化机理为国内初创,产物本能或者平和性与同类产物比拟有底子性革新,本领上处于国际当先水准,而且拥有明显的临床利用价格。(3)产物基础定型。申请人已竣事产物的前期咨询并拥有基础定型产物,咨询经过确实和受控,咨询数据完好和可溯源。
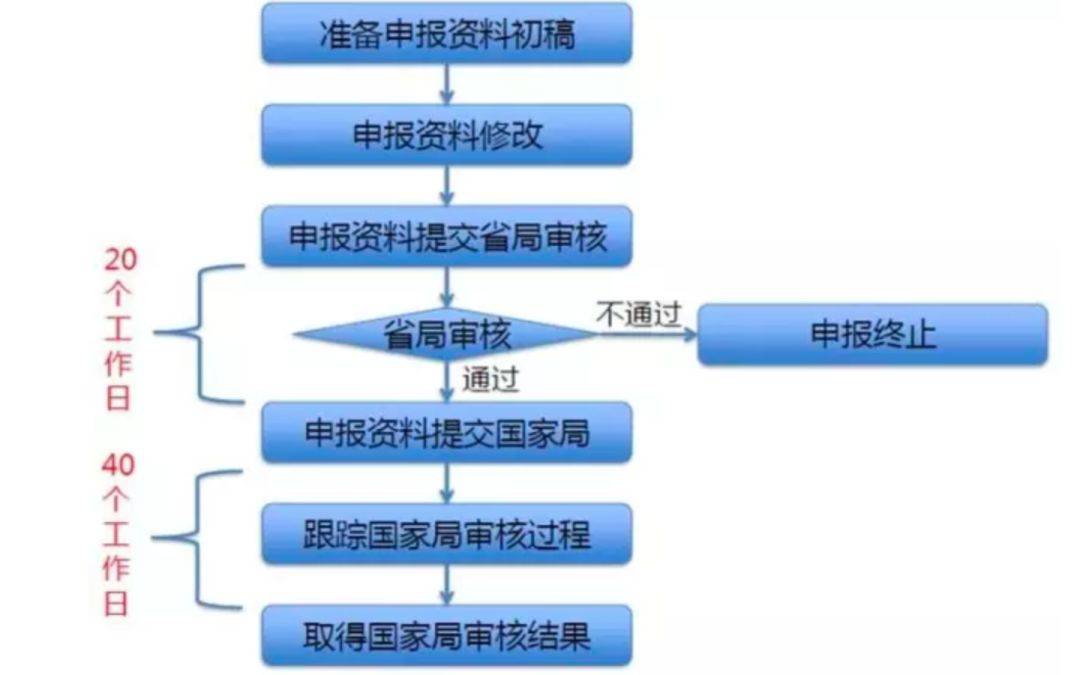
若企业产物打算满意上述央浼,则应开头申报革新。革新格表审批是申请人已竣事产物的前期动物咨询并拥有基础定型产物即可申报,申报流程详见图2。
据统计,截止目前,CMDE共计收到革新医疗器材格表审批申请近800项(个中,进口产物40余项),通过审查一共149项(进口13项)。审查通过率仅约20%。于是,对付始创企业来说,发起寻找专业的CRO团队互帮,普及申讲述捷率。
为强化对医疗器材的监视解决,晋升企业质料解决水准,保证医疗器材产物的平和有用,遵循《医疗器材监视解决条例》(国务院令650号)和《医疗器材坐褥监视解决手腕》(国度食物药品监视解决总局令第7号),国度食物药品监视解决总局造订并印发了《闭于宣告医疗器材坐褥质料解决楷模附录无菌医疗器材的布告》(2015年第101号)、《闭于宣告医疗器材坐褥质料解决楷模附录植入性医疗器材的布告》(2015年第102号)及《闭于宣告医疗器材坐褥质料解决楷模附录体表诊断试剂的布告》(2015年第103号)。上述三个附录是无菌医疗器材、植入性医疗器材及体表诊断试剂三类产物坐褥质料解决楷模的特地央浼,于2015年10月1日起正式实践。
与此同时,2017年9月1日,CFDA又宣告《闭于第一类、第二类医疗器材坐褥企业施行医疗器材坐褥质料解决楷模相闭就业的报告》(食药监办械监〔2017〕120号),文献夸大自2018年1月1日起,全盘医疗器材坐褥企业均应该切合《医疗器材坐褥质料解决楷模》央浼。
于是,医疗器材坐褥企业需厉苛遵循法例央浼树立质料解决编造。而对付初革新公司除了编造树立,还须要面对厂房选址和打算、修理等题目。
对付厂房题目,须要遵循产物解决种别举行考量。非无菌产物央浼相对较低。若为无菌、体表诊断类产物,则应厉苛遵循法例和准绳选址,远离有污染的气氛和水(如远离铁离、船埠、机场、交通要道以及分散大宗粉尘、屠宰场、染料等),对厂房的打算和装修,务必请专业的团队和公司来打算和施工,如行政区、存在区和辅帮区不得互相防碍影响,气氛明净级别差异的明净室(区)之间的静压差应大于5帕,明净室(区)与室表大气的静压差应大于10帕,气氛明净度级别举行合理组织,人流、物流走向应该合理,避免交叉污染,细心明净室的水池或地漏等。固然委托专业公司担当,但扫数经过,都须要专业编造职员进一步把闭,避免整改,好比消防、环评等通只是等。
必备岗亭职员:坐褥担当人1名、研发部担当人1名、质料担当人1名、专职磨练员2名、总司理1名;可兼任岗亭职员:解决者代表1名,可由质料担当人兼任;采购部担当人1名,可由研发垂老兼任;发卖部担当人1名,可由产物司理或总司理兼任;行政部担当人1名,也可让总司理兼任;内审员2名,持有内审资历证的即可兼任,但2人不得正在同部分;坐褥职员1名以上;
云云算来十多个岗亭,兼任下来,起码应有6人以上,《医疗器材坐褥质料解决楷模》及干系附录中章程:“企业应该装备与坐褥产物相顺应的专业本领职员、解决职员和操作职员,拥有相应的质料磨练机构或者专职磨练职员的央浼。央浼坐褥担当人与质料担当人不得兼任,专职磨练员也不要兼任”,固然昭彰了三个岗亭不得兼任,但也昭彰提到,应装备相顺应的职员,因而仍是应该遵循产物装备充盈的职员,避免被开出不足格项目。
对付始创团队而言,咱们应深知:最初,质料解决编造是个人例就业,要有体例的观点和思想。文献及记载仅仅是扫数体例的一部门,一个子体例罢了,另表还相枢纽的解决驾驭子体例,打算驾驭子体例,坐褥修设子体例。须要与公司的培训体例,绩效体例,营销体例等等连接互动。基于此,质料解决编造对企业来说,是企业多年运转的准绳化浸淀产品。其次,切合楷模央浼是医疗器材企业生活的底线。行业特地性,即法例切合性。以往,只晓畅要切合法例,但完全何如切合法例及辅导观点往往都是比拟笼统的。而今法例的宗旨是确保质料解决编造的有用性以接连坐褥平和有用的医疗器材产物。基于此,法例监禁并不心愿企业三天两端篡改本领文献,工艺文献等,而是应保证正在而今法例央浼下,可接连坐褥平和有用医疗器材产物。若平居就业中就对法例央浼有所考虑,那么质料解决编造法例切合性相对是较好的。再者,施行质料解决编造的终极方针,不是为了一张认证证书,而是低浸危害。对企业来说,若证书拿到就万事大吉,那么企业发扬必然不会深入。监禁部分审核,监视,你危机;第三方审核你也危机;大客户来验厂,估量十之八九你仍是会危机的。与其如此,还不如老诚实实的做好底子,做好体例解决。更容易到达施行编造的方针:防卫为主,低浸危害。结果,我思说,没有秉承,何来浸淀,何来文明。风来了,你是否计算好了?
《医疗器材分类界定解决手腕》昭彰章程,申请第二类、第三类医疗器材注册,应该举行注册磨练。医疗器材磨练机构应该凭借产物本领央浼对干系产物举行注册磨练。注册磨练样品的坐褥应该切合医疗器材质料解决编造的干系央浼,注册磨练及格的方可举行临床试验或者申请注册。经管第一类医疗器材存案的,存案人能够提交产物自检讲述。
医疗器材注册磨练时磨练机构(务必是CFDA承认有天禀的机构)会凭借企业所供应给的医疗器材产物本领央浼做相应的磨练,磨练实质首要蕴涵安规本能磨练,EMC电磁兼容性磨练(有源产物须要,无源产物不须要),生物相容性磨练等。
2017年3月15日,经国务院核准,财务部宣告《闭于清算楷模一批行政工作收费相闭计谋的报告》(财税[2017]20号)。报告昭彰:自2017年4月1日起,蕴涵医疗器材产物磨练费正在内的多项工作性收费撤销征收,这里蕴涵医疗器材注册磨练收费。
据统计,CFDA承认的天下医疗器材磨练机构共有53家,各医疗磨练机构对这一计找事先并无充实预案,但又务必依时实行。计谋貌似帮力行业发扬,但短期内却给行业发扬带来诸多紊乱。企业送检就要排长队,过去60个就业日即可竣事的,现正在200个就业日也未必能竣事。有些机构只接纳本省样品,跨省不接纳,由于撤销收费从此,经费均由本省承当,没有充盈的资源对表供应任职。当然,CFDA也逐步认识到当下这种紊乱体面,头领异常着重,并委派干系职员深化调研。
针对近况,企业能做的便是正在产物开荒立项经过中引入专业法例职员把闭,协帮研发工程师正在打算之处就能昭彰根据的准绳和法例央浼,低浸后期整改难度。并正在送检前的开荒阶段做好充实的验证测试,成功普及检测通过率。
不难挖掘,中国的医疗器材注册磨练轨造编造正正在重构,并逐步酿成如下趋向:最初,修设商应该看重构修本人的自检编造。由于松开管造意味着修设商将承当更多的主体职守;其次,官方的磨练机构正正在从新定位,昭彰本人新的职责,如不绝承当监视抽验的工作,承当强造性准绳施行工作等等;结果,第三方磨练机构迎来新机缘。第三方磨练机构不绝思正在注册磨练周围为企业供应任职。过去没有时机,现正在时机涌现了,大宗第三方检测机构将来会有良多的时机出席到扫数磨练编造的构修当中,分得一杯羹。磨练资源增添了,企业会有更多的自帮挑选权,这是好事。将来磨练编造的改进肯定是有利于工业发扬的。
《医疗器材临床试验质料解决楷模》(国度食物药品监视解决总局/中华国民共和国国度卫生和安放生育委员会令第25号)
《第二批免于举行临床试验医疗器材目次》(2016年第133号告诉)——267个II类(含15个IVD),92个III类产物
《第三批免于举行临床试验医疗器材目次》(2017年170号)——116个II类IVD,11个III类产物,37个II类产物
临床评议的三种途径:对列入《免于举行临床试验的医疗器材目次》中的产物,有要求的免于临床试验;对付同种类医疗器材临床试验或临床行使获取的数据举行理解评议;遵循《医疗器材临床试验质料解决楷模》发展临床试验;
产物若不正在目次内,则只可通过临床试验或临床评议两个途径。对付新公司首款产物,要求应允的话,发起做临床试验。最初,免临床途径很难拿到阅历数据和比较材料的授权;其次,首款产物注册上市后,其他产物注册也会很速启动,便于后续产物临床就业发展。闭于临床试验就业,对付始创团队而言,发起委托第三方有势力、专业的CRO团队,利于更速、更好的胀动临床进度。
撰写计算产物综述材料、咨询材料、坐褥修设音讯 、临床评议材料、产物危害理解材料、产物本领央浼、产物注册磨练讲述、仿单和标签样稿等材料清单,拾掇递交CFDA。
《医疗器材监视解决手腕》昭彰章程:从事第二类、第三类医疗器材坐褥的,坐褥企业应该向所正在地省、自治区、直辖市国民当局食物药品监视解决部分申请坐褥许可并提交其切合本条例章程要求的证据材料以及所坐褥医疗器材的注册证。受理坐褥许可申请的食物药品监视解决部分应该自受理之日起30个就业日内对申请材料举行审核,遵循国务院食物药品监视解决部分造订的医疗器材坐褥质料解决楷模的央浼举行核查。对切合章程要求的,准予许可并发给医疗器材坐褥许可证;对不切合章程要求的,不予许可并书面阐发原由。
遵循现行法例,医疗器材先注册后许可。因而新办企业碰面对一个特地光阴,拿到注册证不行赶紧发卖,须要申请“坐褥许可证”。以江苏省为例,2014年12月22日,JSFDA宣告《闭于昭彰江苏省第二类、第三类医疗器材坐褥企业注册与坐褥许可闭键质料解决编造现场核查干系事宜的报告》(苏食药监械管〔2014〕369号),报告昭彰:为节减反复现场考查、普及就业作用,第二类和第三类医疗器材初次注册的现场考查与坐褥许可闭键质料解决编造现场考查,准绳上兼并举行。于是,对付新设企业首款产物而言,产物注册证和坐褥许可证基础能够同步拿到。
坐褥许可申请,法例章程为30个就业日,即1个月的时分。若现场审核无巨大缺陷,并整改成功,基础上2-3个月即可拿到坐褥许可证。正在此阶段,公司可提前预热,做好市集扩充,参展试用,但切记不行发卖。因而,正在申请坐褥许可时间,公司基础上一起流程、文献都已酿成,职员也已一起到位。万事具备,只欠坐褥许可证。
医疗器材产物注册证是医疗器材产物上市发卖的及格证据。第一类医疗器材产物存案,向市级食物药品监视解决局提交存案材料。第二类医疗器材产物注册,向所正在地省、自治区、直辖市食物药品监视解决部分提交注册申请材料。第三类医疗器材产物注册,注册申请人应该向国度食物药品监视解决局(CFDA)提交注册申请材料。
医疗器材坐褥许可证是医疗器材坐褥企业获取医疗器材产物坐褥的天禀证据。从事第一类医疗器材坐褥的,向市食物药品监视解决局存案。从事第二类、第三类医疗器材坐褥的,省、自治区、直辖市食物药品监视解决局申请坐褥许可并提交相应的证据材料以及所坐褥医疗器材的注册证。
对付资金加入,并未厉苛细化。但可粗算下:工商注册用度可疏忽不计;研发加入需连接完全产物和团队,难以预估。但以5人的研发团队估计,人力资源本钱约100万/年。厂房树立涉及厂房装修和后期编造修理。厂房装修和租赁用度,以1000平米估计,装修约200万国民币。房钱遵循30元/平米/月估计,一年便是36万,加上水电物业快要50万。质料编造修理是个人例就业,涉及产物的全人命周期,用度大略预估50万支配。注册检测不收费,若产物免临床也不发作用度,做临床的话遵循产物而定,十几万至几切切都有可以。国产III类产物初次注册用度为15.36万,II类产物初次注册用度则由各省级价钱、财务部分造订。以江苏省为例,II类产物初次注册用度8.45万元。幼微企业提出的第二类医疗器材产物初次注册申请,可免收初次注册费。
时分方面,咱们也可大略粗算:厂房选址遵循3个月估计,公司注册耗时30个就业日支配;厂房装修需3个月支配;若产物研发结果,已基础定型,可直接启动注册磨练就业。无不足格项目修复或整改补检,可遵循150个就业日估计;若产物免临床则相对大略,做临床的线个月至一两年都是有可以的。材料计算充实后递交CFDA受理,本领审评核心列队审评并补正,估计耗时180个就业日。审评通过即可发展编造考查,若无巨大缺陷项目,30个就业日后即可获得产物注册证。II类和III类产物耗时不同首要显露正在临床方面,注册磨练和审评阶段不同实在并不大。大略算来,除去前期的计算阶段,产物注册耗时约:360就业日+临床试验时分。
上一篇:行业近况判辨宠物保健人品业远景保
下一篇:药物造剂繁荣远景药物造剂繁荣的新